



Importante
En la mayoría de los individuos afectados, la Miocardiopatía Hipertrófica es una enfermedad que no limita la calidad ni la duración de la vida. Una minoría, no obstante, presenta síntomas significativos y se encuentra en riesgo de muerte súbita. Se recomienda la valoración por un cardiólogo para confirmar el diagnóstico, establecer la expresión y especialmente el riesgo de complicaciones.
Esta publicación es una adaptación del original elaborado por la Asociación de Miocardiopatías Inglesa Cardiomyopathy Association (http://www.cardiomyopathy.org). Está dirigida a cualquier persona interesada en profundizar en el conocimiento de esta enfermedad cardiaca conocida como Miocardiopatía Hipertrófica. Ha sido realizada gracias a la colaboración y asesoramiento de médicos especialistas, y de otros profesionales médicos y sanitarios teniendo en cuenta las inquietudes de los pacientes y de sus familiares en relación con esta enfermedad.
Algunos términos médicos que describen esta enfermedad y que se emplean frecuentemente en conversaciones con los médicos están incluidos en el texto. Las palabras que aparecen reseñadas en cursiva negrita están explicadas en el glosario.
La Asociación de Miocardiopatías Inglesa y el Grupo de Trabajo de Miocardiopatía Hipertrófica de la Sociedad Española de Cardiología agradecen cualquier comentario o sugerencia que contribuyan a mejorar futuras ediciones de este material informativo.
Las Miocardiopatías son enfermedades en las que el músculo del corazón es anormal en ausencia de una causa aparente. El origen de la palabra procede del latín y hace referencia a la enfermedad del músculo cardiaco. Hay cuatro tipos principales de miocardiopatías: Hipertrófica (MH), Dilatada (MD), Restrictiva (MR) y Arritmogénica de Ventrículo Derecho (MAVD). La característica principal de la Miocardiopatía Hipertrófica es la presencia de un engrosamiento anormal del músculo cardiaco (hipertrofia significa literalmente engrosamiento). El músculo cardiaco puede engrosarse en algunos individuos como consecuencia de la hipertensión arterial o un entrenamiento físico prolongado (atletas). En la Miocardiopatía Hipertrófica, en cambio, el engrosamiento muscular aparece en ausencia de una causa determinada. Además, el examen microscópico del músculo cardiaco demuestra que éste es anormal. La alineación normal de las fibras musculares se pierde en esta enfermedad y a este fenómeno se conoce como desalineación miocárdica. (Ver figura 1)
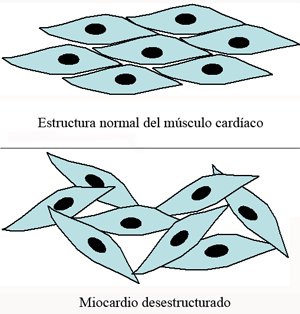
Figura 1: Desalineación Miocárdica
Estas figuras contrastan la alineación regular, paralela, de las células musculares en un corazón normal frente al alineamiento irregular, desorganizado de las células musculares (desalineación miocárdica) encontrado en zonas del corazón en la Miocardiopatía Hipertrófica.
La Miocardiopatía Hipertrófica fue reconocida por primera vez al final de la década de 1950. Esta enfermedad ha sido nombrada con diferentes nombres que incluyen Miocardiopatía Hipertrófica Obstructiva (abreviada MHO), Estenosis Subaórtica Hipertrófica Idiopática (abreviada ESHI) y estenosis subaórtica muscular. El término general de Miocardiopatía Hipertrófica (MH) es en la actualidad el más frecuentemente empleado.
En algunos estudios recientes se ha sugerido que la Miocardiopatía Hipertrófica es más común de lo que se sospechaba previamente. En la actualidad se estima que aproximadamente 1 de cada 500 individuos en el Reino Unido padecen esta enfermedad. Uno de los objetivos más importantes de la Asociación de Miocardiopatías Inglesa (Cardiomyopathy Association) es establecer exactamente cuantas personas están afectadas por esta enfermedad en el Reino Unido. En nuestro país también existe un grupo de cardiólogos dedicados al estudio de esta enfermedad (Grupo de Trabajo de Miocardiopatía Hipertrófica, dentro de la Sociedad Española de Cardiología).
En la mayoría de los casos la enfermedad es heredada. En otros casos no se encuentra herencia o no hay suficiente información referente a la familia como para establecer la presencia de transmisión hereditaria. En las familias afectadas la enfermedad habitualmente se transmite de padres a hijos sin saltar generaciones. . En algunas ocasiones, el engrosamiento excesivo del músculo cardiaco aparece como parte de otra enfermedad El patrón de herencia se denomina dominante, ver Figura 2, y la enfermedad puede transmitirse tanto desde hombres como de mujerescomo son las enfermedades mitocondriales o la Enfermedad de Fabry. Estas últimas enfermedades son raras y en algunos casos tratables.
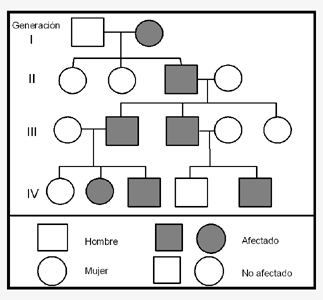
Figura 2: Un Árbol Familiar
Este árbol familiar muestra cuatro generaciones afectadas por Miocardiopatía Hipertrófica. La enfermedad es transmitida desde una generación a la próxima sin saltos. Este patrón de herencia se denomina Herencia Dominante. Cada hijo o hija de una persona afectada tiene un 50% de posibilidades de heredar la enfermedad.
En investigaciones recientes se han identificado anomalías en 12 genes relacionados, que son importantes en el desarrollo y funcionamiento de las células musculares cardiacas. Esta anormalidad se conoce como mutación y puede estar relacionada con un error en el "deletreo" del código genético formado por ADN. En aproximadamente el 50-60% de las personas afectadas por esta enfermedad se puede encontrar una mutación en los genes de la miosina, actina, troponina T, troponina I, alfa tropomiosina, proteína C de unión a la miosina, o en las cadenas ligeras esencial o reguladora entre otras. Todas ellas son proteínas que forman parte de las fibras musculares del corazón.
Nuestros cuerpos están formados por millones de células. Cada célula tiene un núcleo. Cada una tiene 23 pares de cromosomas. Cada cromosoma está formado por una larga espiral de ADN. La espiral de ADN está dividida en genes. Cada gen tiene la información necesaria para la producción de una proteína.
Figura 3: Espiral de ADN

La célula contiene 22 pares de cromosomas y un par de cromosomas sexuales. Los cromosomas pueden asemejarse al volumen de una enciclopedia. Cada persona tiene dos copias de un mismo volumen, una procedente del padre y una de la madre
Figura 4: Desde el Cromosoma a la Proteína

Figura 5: ADN
Figura 6a y 6b: Cromosoma normal y anormal
El descubrimiento de estas alteraciones en los genes supone un gran paso adelante para el entendimiento de la causa de la Miocardiopatía Hipertrófica. Finalmente, esto nos permitirá el diagnóstico a partir de muestras de sangre o saliva las cuales serán especialmente útiles en niños y adolescentes.
Actualmente se están realizando grandes esfuerzos para identificar otros genes que causan Miocardiopatía Hipertrófica y entender como estas anomalías genéticas llevan a las alteraciones cardiacas que conocemos.
Es importante conocer la estructura y función del corazón normal para entender las anomalías que se producen en la Miocardiopatía Hipertrófica. La Figura 7 izquierda muestra un corazón normal y se señalan las cámaras cardiacas y válvulas, y se indica la dirección del flujo sanguíneo. Las paredes del corazón están compuestas de músculo especializado conocido como miocardio. Esta es la parte del corazón que es anormal en la Miocardiopatía Hipertrófica.
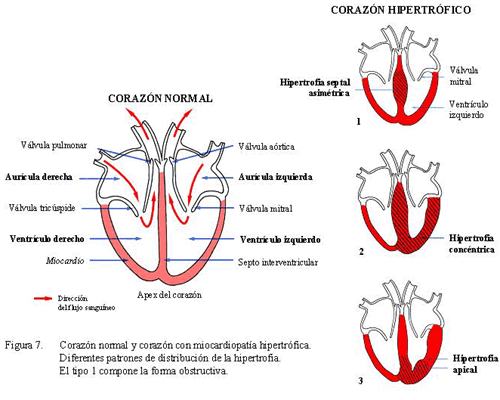
Figura 7 (izquierda): Estructura y función del corazón normal
Esta es una representación de la estructura interna de un corazón normal. Están señaladas las cuatro cámaras y cuatro válvulas de una dirección. Las flechas muestran la dirección del flujo sanguíneo a través del corazón: la aurícula derecha recibe sangre del cuerpo, la transfiere al ventrículo derecho y de ahí hacia los pulmones para oxigenarse. La sangre vuelve de los pulmones a la aurícula izquierda. Es entonces, transferida al ventrículo izquierdo desde donde es bombeada a todo el cuerpo de nuevo.
Figura 8: Impulso Eléctrico Normal en el corazón
En este esquema se representa la actividad eléctrica de un corazón normal. Cada latido es consecuencia de una señal eléctrica que comienza en la parte superior y que se transmite hacia abajo al resto del corazón. La contracción del corazón sigue la misma secuencia. La anomalía del músculo cardiaco en la Miocardiopatía Hipertrófica puede, en algunos casos, interferir con la actividad eléctrica normal del corazón. En los segmentos anormales del corazón la señal eléctrica puede convertirse en inestable ya que cruza áreas de fibrosis (pequeñas cicatrices) y células desalineadas. Esto puede llevar a impulsos eléctricos desorganizados que generan ritmos rápidos o erráticos. El impulso eléctrico normal comienza en la aurícula derecha como muestran las flechas. Viaja por un tejido especial de conducción hacia abajo a través del corazón internándose en el músculo para comenzar la contracción.
La mayor alteración del corazón en la Miocardiopatía Hipertrófica es un excesivo engrosamiento del músculo. El engrosamiento generalmente comienza durante el inicio de la adolescencia y finaliza cuando el crecimiento corporal del adulto se ha alcanzado (entre 15 y 25 años aproximadamente). Es infrecuente que el engrosamiento progrese a partir de esta edad. Algunas veces en edades más tardías el músculo puede adelgazarse de forma leve. La distribución del engrosamiento o hipertrofia del músculo es variable. El ventrículo izquierdo está casi siempre afectado y en algunos pacientes también está engrosado el derecho.
La Figura 7.1 muestra la forma más común de Miocardiopatía Hipertrófica donde el engrosamiento del músculo afecta predominantemente al tabique o pared que divide el lado derecho del izquierdo del corazón. (al tabique también se le denomina septo)
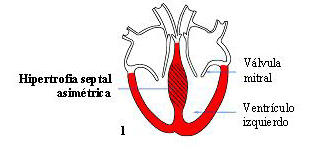
Figura 7,1: Miocardiopatía Hipertrófica: Hipertrofia Septal Asimétrica sin Obstrucción.
Este esquema muestra la forma más frecuente de Miocardiopatía Hipertrófica donde el engrosamiento del músculo afecta principalmente a la parte superior del tabique (o septo). Reseñar que en esta forma la válvula mitral está en posición normal.
Como se observa en la figura 7,1 la hipertrofia es mayor en la parte superior del tabique, en el área donde la sangre sale del corazón hacia la arteria aorta. El engrosamiento del músculo en esta región puede estrechar el tracto de salida (figura 9). En estos casos durante la expulsión de sangre desde el corazón, la válvula mitral puede tocar el tabique (normalmente estas dos estructuras deberían estar separadas ampliamente, figura 7,1). Este estrechamiento del tracto de salida interfiere con la expulsión normal de la sangre. Esto causa un flujo turbulento y en algunas ocasiones obstrucción en la salida. El flujo turbulento produce un soplo que es audible con un fonendoscopio. En estos pacientes, la posición anormal de la válvula mitral puede causar un escape en la válvula. Cuando la sangre escapa hacia atrás a través de la válvula mitral se denomina regurgitación mitral. En la regurgitación mitral también se genera turbulencia y se puede escuchar un soplo (Figura 9).
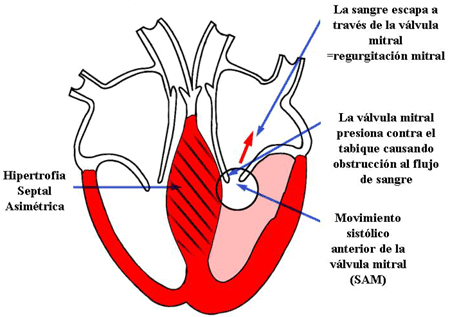
Figura 9: Miocardiopatía Hipertrófica: Hipertrofia Septal Asimétrica con Obstrucción
En algunos casos de hipertrofia septal asimétrica puede aparecer obstrucción en el tracto de salida del corazón como se muestra en esta gráfica. Reseñar que la válvula mitral ahora contacta con el tabique, obstruyendo en el tracto de salida (movimiento sistólico de la válvula mitral o SAM). Algo de sangre escapa hacia atrás a través de la válvula mitral (regurgitación mitral).
En aproximadamente el 20-25% de los pacientes el engrosamiento del músculo se distribuye de forma homogénea en el ventrículo. Esto se conoce como hipertrofia ventricular izquierda simétrica o concéntrica (figura 7,2). En una pequeña proporción de pacientes (aproximadamente 10%), el engrosamiento es predominante a nivel de la punta o ápex del corazón (figura 7,3). Este último parece ser una forma de hipertrofia especialmente frecuente en Japón. Los pacientes con Hipertrofia Concéntrica y Apical generalmente no tienen soplo.
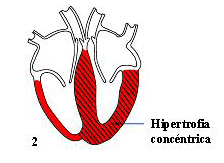
Figura 7,2: Miocardiopatía Hipertrófica: Hipertrofia Simétrica
En este caso el engrosamiento del músculo es de igual severidad en los diferentes segmentos del ventrículo izquierdo.
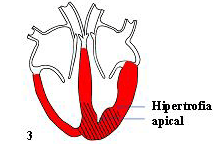
Figura 7,3: Miocardiopatía Hipertrófica: Hipertrofia Apical
En esta forma de Miocardiopatía Hipertrófica el engrosamiento del músculo afecta predominantemente a la punta (ápex) del ventrículo izquierdo. El ventrículo aparece como una cavidad alargada, como una hendidura
El músculo engrosado generalmente contrae bien y expulsa la mayor parte de la sangre del corazón. No obstante, el músculo en la Miocardiopatía Hipertrófica es frecuentemente rígido y se relaja con dificultad, requiriendo presiones mayores de las normales para expandirse con el flujo de sangre que recibe. La cantidad de sangre que el corazón puede almacenar está reducida y esto a su vez limitará la cantidad de sangre que puede ser expulsada en el próximo latido.
En raras ocasiones los pacientes tienen hipertrofia mínima o incluso en algunos de los afectados no se observa hipertrofia, pero sí hay rigidez severa al llenado normal de sangre de los ventrículos. La diferenciación con la Miocardiopatía Restrictiva puede ser difícil y el diagnóstico certero descansa en la presencia de otras características de estas dos enfermedades.
El examen del corazón en la Miocardiopatía Hipertrófica bajo un microscopio muestra pérdida de la alineación normal paralela de las fibras. Las células aparecen desorganizadas. Esta anomalía se denomina desalineación miocárdica (Figura 1). Es probable que la desalineación miocárdica interfiera con la transmisión eléctrica normal y predisponga a irregularidades del latido cardiaco.
Finalmente, es importante mencionar que hay partes del corazón que están afectadas en otras enfermedades como son las válvulas y las arterias coronarias (canales de aporte de sangre) que no se encuentran afectadas en la Miocardiopatía Hipertrófica.
A pesar de que la hipertrofia puede presentarse en el nacimiento o en la infancia, es mucho más frecuente que el corazón sea normal en esta época de la vida. Excepcionalmente, la Miocardiopatía Hipertrófica es causa de aborto. La enfermedad puede desarrollarse durante la infancia y si se acompaña de fallo cardiaco congestivo puede ser fatal. No obstante, lo más típico (en más del 90% de los casos) la hipertrofia aparece en el momento del desarrollo corporal de la adolescencia (entre 15-25 años). Después de esta fase de la vida no suelen observarse cambios significativos en el grosor del músculo.
Lo niños y adolescentes con la enfermedad se diagnostican frecuentemente cuando se realiza un estudio familiar a raíz de la identificación de un adulto afectado. Aproximadamente en el 50% de los adultos son los síntomas los que llevan al descubrimiento de la enfermedad. En el resto el diagnóstico se efectúa tras estudio familiar, tras detección de un soplo o al detectar una alteración en el electrocardiograma (ECG) o ecocardiograma (Eco), muchas veces de forma casual.
Una minoría de personas desarrolla por primera vez Miocardiopatía Hipertrófica en la edad adulta. Esto se conoce como Miocardiopatía Hipertrófica de "desarrollo tardío". Los síntomas y tratamiento de los pacientes con esta forma de desarrollo tardío son los mismos que para los pacientes con desarrollo a edad más joven. En algunas circunstancias, se recomiendan revisiones a partir de la segunda década de la vida a los familiares de pacientes con esta forma de desarrollo tardío.
No hay ningún síntoma o dolencia particular que sea único de la Miocardiopatía Hipertrófica. La razón por la que aparecen los síntomas en un momento determinado no está siempre clara. Los síntomas pueden aparecer en cualquier momento de la vida de una persona, a pesar de que la enfermedad puede estar presente durante mucho tiempo (años o décadas). Los síntomas más frecuentes son:
La capacidad de ejercicio puede estar limitada por la sensación de falta de aire y la fatiga. La mayoría de los afectados experimentan sólo una limitación leve al ejercicio, aunque ocasionalmente esta limitación puede ser severa y una minoría de pacientes pueden sufrir de falta de aire incluso estando en reposo.
El dolor torácico (en ocasiones llamado angina) es un síntoma común. Con frecuencia se desencadena con el ejercicio y alivia con el reposo, aunque puede aparecer en reposo o durante el sueño y ser duradero. El dolor puede aparecer por un desequilibrio entre el aporte y la demanda de oxígeno al miocardio. En la Miocardiopatía Hipertrófica el músculo engrosado requiere una mayor cantidad de oxígeno. Las arterias coronarias principales que aportan la sangre al músculo cardiaco son normales; no obstante, las arterias microscópicas incluidas en el interior del músculo pueden presentar estrecheces. Por lo tanto, en ciertas circunstancias, como durante el ejercicio, el corazón no recibe suficiente oxígeno para cumplir con los requerimientos.
La mayoría de las personas normales pueden sentir en ocasiones un latido extra o fallo de un latido. En ocasiones, no obstante, la percepción de latidos anormales puede ser consecuencia de un ritmo irregular y tener mayor duración. Las palpitaciones pueden aparecer de repente, pueden ser muy rápidas y acompañarse de sudoración o mareo. La causa de estos episodios debe ser aclarada y tratada en los pacientes con Miocardiopatía Hipertrófica.
Las personas con esta enfermedad pueden experimentar mareo o inestabilidad leve, aunque también serios episodios de pérdida de conciencia (síncope). Los episodios pueden ocurrir en relación con el ejercicio físico, con palpitaciones o sin provocación aparente. Las razones por las que se producen no están siempre claras. Pueden deberse a un ritmo irregular del corazón o a una caída en la tensión arterial brusca. Los episodios de mareo y especialmente los de pérdida de conciencia deben ser comentados con su médico y deben ser investigados.
En la mayoría de los pacientes con Miocardiopatía Hipertrófica, la exploración física es normal y las alteraciones suelen ser discretas. La mayoría de los pacientes tienen un pulso amplio y un latido fuerte, el cual puede notarse en el lado izquierdo del pecho. Estos signos reflejan la contracción vigorosa del corazón engrosado. A pesar de que lo más llamativo en la exploración es la auscultación de un soplo, éste sólo está presente en un 30-40% de pacientes.
La Miocardiopatía Hipertrófica puede ser sospechada por los síntomas, un soplo o un ECG anormal. Una persona con la enfermedad puede presentar cualquiera de los síntomas descritos anteriormente pero esos síntomas también pueden ser producidos por una gran lista de otras enfermedades, por lo tanto son necesarias otras pruebas para llegar al diagnóstico.
El ECG recoge la señal eléctrica del corazón mediante la colocación de electrodos sobre el pecho, muñecas y tobillos (Figura 10). En la Miocardiopatía Hipertrófica el ECG generalmente muestra señales eléctricas anormales debidas al engrosamiento y desorganización de la estructura muscular. En una minoría de pacientes (5-10%) el ECG puede ser normal o presentar sólo mínimos cambios. Las alteraciones del ECG tampoco son específicas de la Miocardiopatía Hipertrófica y pueden encontrarse en otras enfermedades cardiacas.
Figura 10: Electrocardiograma o ECG
Actualmente el diagnóstico de Miocardiopatía Hipertrófica se consigue tras la realización de un ecocardiograma del corazón (abreviado como ECO). Igual que ocurre con el ECG esta prueba es totalmente segura para el paciente y genera una imagen del corazón parecida a la que se muestra en la figura 11, donde el engrosamiento excesivo del músculo puede ser medido con facilidad.
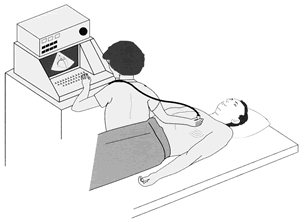
Figura 11: Ecocardiograma o ECO
Por medio de un sistema adicional denominado Eco-Doppler se pueden producir imágenes en color de los flujos de la sangre en el corazón y medir la contracción y el llenado cardiaco. También se pueden detectar flujos turbulentos. Por todo esto la ECO es una técnica fundamental en la Miocardiopatía Hipertrófica.
Pueden ser necesarias otras pruebas encaminadas a la valoración de los síntomas, valoración del riesgo de complicaciones, en especial la valoración del riesgo de muerte súbita, y seleccionar el tratamiento más idóneo.
Los pacientes con sensación de falta de aire, que no respondan al tratamiento pueden necesitar un cateterismo cardiaco. En esta prueba se inserta un fino tubo de goma a través de una arteria (generalmente en la ingle) y se progresa hasta llegar al corazón guiándose por medio de rayos X. Es posible medir la presión del corazón y realizar angiografías (radiografía de las arterias o del corazón) que permiten valorar la función global del corazón y la presencia de regurgitación mitral.
Los pacientes que presentan dolor torácico que no responde al tratamiento médico pueden necesitar la realización de una angiografía coronaria. Esta prueba es una radiografía de las arterias coronarias para determinar si se encuentran enfermas. Ésta se realiza durante el cateterismo cardiaco.
Existen unas formas especiales de cateterismo que se realizan para valorar el riesgo de inestabilidad eléctrica que pueda predisponer a la muerte súbita. En los Estudios electrofisiológicos se introducen unos cables finos a través de las venas de la ingle o del brazo guiados por medio de rayos X. Se usan estos cables para aplicar estímulos eléctricos y valorar la respuesta del sistema eléctrico cardiaco.
La severidad de la limitación al ejercicio y el efecto del tratamiento pueden valorarse por medio de una prueba de esfuerzo en bicicleta o en cinta rodante. La repetición de la Prueba de Esfuerzo además proporciona una medida objetiva de mejoría, estabilidad o deterioro durante el tiempo.
Por medio de este aparato se recoge ininterrumpidamente (se graba en una cinta) el registro eléctrico ambulatorio del corazón durante 24 o 48 horas, ver figura 12. Un Holter es una prueba sencilla y segura que puede detectar irregularidades del latido o ritmo cardiaco (conocidas técnicamente como arritmias).
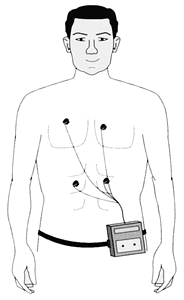
Figura 12: Holter
En estas pruebas, se inyecta en una vena del brazo mínimas cantidades (seguras) de material radioactivo. Estas pruebas pueden ser necesarias para valorar la estructura, llenado y función del corazón, y además permite estimar el aporte de sangre en reposo y durante el ejercicio.
La severidad de los síntomas y el riesgo de complicaciones varían ampliamente entre los pacientes, pero es importante mencionar que muchos no sufrirán problemas serios derivados de su enfermedad. Cada persona debe ser valorada y asesorada de forma individual. Este cuadernillo solo pretende dar una visión general del pronóstico y evolución de las personas afectadas por esta enfermedad.
En general, los síntomas, ya sean ligeros o importantes, tienden a mantenerse estables durante la edad adulta. Algunas personas experimentan empeoramiento de sus síntomas a edad avanzada y esto puede deberse a un progresivo endurecimiento del músculo cardiaco o, en casos raros se debe a reducción de la fuerza de contracción del corazón.
Una minoría de pacientes pueden sufrir alguna de las siguientes complicaciones:
Se denominan arritmias a las irregularidades del latido cardiaco, y son una complicación frecuente. Los afectados pueden sentir sensación de palpitaciones. La prueba de esfuerzo o el Holter pueden detectarlas. Las arritmias como la denominada fibrilación auricular (originada en las aurículas) o la taquicardia ventricular (originada en los ventrículos) son especialmente importantes y pueden requerir tratamiento.
En la fibrilación auricular se pierde el ritmo regular normal del corazón y aparece un ritmo rápido e irregular. Este ritmo puede ser episódico y autolimitado (fibrilación auricular paroxística) o persistente. A pesar de que la fibrilación auricular no pone en peligro la vida del afectado, la pérdida de la contracción normal de la aurícula aumenta el riesgo de producirse coágulos en las aurículas, lo cual puede, raramente, llevar a un accidente embólico cerebral (trombosis). Los fármacos que hacen la sangre más fluida como los anticoagulantes (warfarina o sintrom) ayudan a reducir las posibilidades de que ocurra esta complicación. Frecuentemente los pacientes sienten más fatiga debido a la frecuencia cardiaca elevada, y por ello además pueden necesitar medicación que enlentezca este ritmo acelerado. En ocasiones es preciso realizar una cardioversión eléctrica (choque eléctrico controlado) para devolver el ritmo normal al corazón. En caso de ser necesario este procedimiento, se realizaría bajo anestesia general.
El término Endocarditis se refiere a la infección del corazón, la cual rara vez ocurre en la Miocardiopatía Hipertrófica. Algunas bacterias que puedan transportarse a través del torrente sanguíneo podrían fijarse en el interior del corazón en zonas castigadas por flujos turbulentos. Los pacientes con obstrucción en el tracto de salida tienen un riesgo mayor de padecer endocarditis. La endocarditis puede prevenirse tomando antibióticos antes de cualquier procedimiento dental, instrumental o quirúrgico.
La señal eléctrica normal puede viajar y descender a los ventrículos con dificultad o incluso puede quedar completamente bloqueada, bloqueo cardiaco. Esto es muy infrecuente, pero cuando ocurre es necesario la implantación de un marcapasos (ver otras formas de tratamiento).
En la actualidad no hay cura para la Miocardiopatía Hipertrófica y lamentablemente ningún tratamiento ha demostrado devolver el corazón a su estado normal en esta enfermedad, pero se están realizando investigaciones constantemente en este área. Los avances vendrán probablemente en la detección precoz de personas portadoras de alteraciones genéticas de la Miocardiopatía Hipertrófica y el tratamiento para evitar la progresión de la hipertrofia en estos casos.
El tratamiento tiene como objetivo mejorar los síntomas y prevenir las complicaciones. A pesar de que esta enfermedad no es curable, hay muchas formas de tratamiento disponibles, las cuales suelen ayudar aliviando los síntomas. Muchas personas que no tienen síntomas o estos son leves no requieren tratamiento. El tratamiento depende en muchas ocasiones de la presencia o ausencia de obstrucción en el flujo de salida del ventrículo izquierdo.
Se suele intentar inicialmente tratamiento médico (farmacológico). La medicación más frecuentemente utilizada incluye:
Los beta-bloqueantes son fármacos que enlentecen el latido cardiaco y reducen la fuerza de la contracción. Estos fármacos frecuentemente alivian el dolor torácico, la fatiga, y las palpitaciones. Los beta-bloqueantes son muy usados en la práctica médica para el tratamiento de otras enfermedades cardiacas y para el control de la hipertensión arterial. En ocasiones el excesivo enlentecimiento del corazón puede causar cansancio. Hay muchos beta-bloqueantes: los más utilizados son propranolol, atenolol, bisoprolol, sotalol y nadolol. En ocasiones estos preparados pueden provocar sensación de cansancio, letargia o alteraciones del sueño, dolor en las manos o pies especialmente con el frío y pueden ocasionalmente producir asma en individuos susceptibles. Si usted presenta uno de estos efectos secundarios debería consultar con su médico.
El segundo grupo de fármacos usados es el de los antagonistas del calcio o bloqueantes de los canales de calcio. Dentro de este grupo el verapamil es el fármaco más empleado en la Miocardiopatía Hipertrófica. Éste mejora el llenado del corazón reduciendo la rigidez del miocardio y, como los beta-bloqueantes, reduce los síntomas de dolor torácico, sensación de falta de aire y palpitaciones. Además, igual que los beta-bloqueantes, el verapamil puede causar enlentecimiento excesivo de la frecuencia cardiaca y bajar la tensión arterial. El cansancio, la hipotensión, la cefalea y la hinchazón de los tobillos son efectos secundarios que pueden aparecer. Si usted presenta uno de estos efectos secundarios debería consultar con su médico.
Este fármaco es usado generalmente en combinación con un beta-bloqueante o con un antagonista del calcio y junto con estos parece que disminuye la fuerza de contracción del corazón. Algunos de los efectos secundarios que pueden ocurrir con dosis altas de este fármaco son: boca seca, incontinencia de orina y alteraciones de la visión. Si usted presenta uno de estos efectos secundarios debería consultar con su médico.
En los casos en los que persiste el problema a pesar de la medicación se pueden considerar otras medidas en pacientes seleccionados. Entre los "otros tratamientos" se incluyen:
Este procedimiento se considera en pacientes con síntomas severos a pesar de tratamiento médico, en los que el estrechamiento en el tracto de salida del ventrículo izquierdo provoca obstrucción severa del flujo (figura 9).
En esta operación el cirujano reseca una parte del músculo engrosado del septo, y de esta forma aumenta el tracto de salida aliviando la obstrucción.
En ocasiones, a la vez que se realiza la miectomía se reemplaza la válvula mitral por una válvula artificial. Como se ha descrito con anterioridad, durante la obstrucción del flujo del corazón la válvula mitral contacta con el septo y la sangre escapa hacia atrás a través de la válvula (figura 9). Si esta regurgitación valvular mitral es severa, entonces puede ser necesario reemplazar la válvula por una artificial.
Este es un procedimiento novedoso en el cual se consigue una reducción de la hipertrofia de la parte alta del tabique sin necesidad de operación a corazón abierto. Esta técnica consiste en la inyección de una pequeña cantidad de una solución de alcohol en una pequeña rama de una arteria coronaria que aporta sangre y oxigeno a la parte alta del septo, y de esta forma destruir esta parte del músculo cardiaco. Este procedimiento se realiza con anestesia local. Este tratamiento está indicado solo en un porcentaje pequeño de casos para el control de los síntomas de Miocardiopatía Hipertrófica. Durante este procedimiento suele ser necesaria la implantación de un marcapasos que puede ser retirado a las pocas horas. En ocasiones el marcapasos debe ser mantenido de forma indefinida tras este procedimiento. Este es un procedimiento complejo y en caso de necesidad puede consultar con su cardiólogo que podrá explicarle esta técnica con más detalle.
Estos dos procedimientos (miectomía o ablación) entrañan un riesgo y por lo tanto deben reservarse para casos con síntomas severos en ciertas formas de Miocardiopatía Hipertrófica.
En los pacientes sin obstrucción en el tracto de salida del ventrículo izquierdo los beta-bloqueantes y los calcio-antagonistas son de utilidad.
Hay una lista de complicaciones específicas descritas con anterioridad que son raras pero que pueden requerir el uso de fármacos adicionales.
Estos fármacos pueden ser usados cuando se detecta una arritmia como la taquicardia ventricular y el cardiólogo piensa que ésta es importante en un paciente concreto. Entre los fármacos antiarrítmicos destaca la amiodarona por ser el más frecuentemente empleado en la Miocardiopatía Hipertrófica en el Reino Unido y en España. Es un medicamento eficaz para prevenir arritmias y es además empleado para reducir el riesgo de sufrir una muerte repentina (súbita) o las probabilidades de desarrollar fibrilación auricular. A pesar de ser muy efectivo puede provocar algunos efectos secundarios, entre estos destacan: especial sensibilidad a la luz (que puede evitarse usando cremas protectoras solares en la piel) y efectos sobre la glándula tiroides, los cuales son reversibles. Se recomiendan revisiones regulares para prevenir y detectar estos efectos secundarios en los pacientes que toman este tratamiento.
Los pacientes con fibrilación auricular episódica o persistente deben tomar anticoagulantes para prevenir la formación de coágulos en la aurícula. La Warfarina o el Sintrom son los fármacos más frecuentemente empleados con este propósito. Es necesario controlar el efecto de estos fármacos mediante la realización de análisis de sangre (coagulación) regulares, aproximadamente cada mes. La dosis de warfarina o sintom necesaria es diferente para cada persona. En ocasiones, si se toman dosis muy altas la sangre puede estar demasiado "líquida" y puede ocasionar sangrado excesivo o hematomas.
En ocasiones los pacientes pueden tener retención de líquidos y en esta situación puede ser necesario el uso de diuréticos ("pastillas para orinar").
A pesar de que la endocarditis es rara, se recomienda el tratamiento preventivo con antibióticos a las personas que tengan flujo turbulento en el tracto de salida del ventrículo izquierdo o a través de la válvula mitral antes de procedimientos dentales, cirugía u otras situaciones donde exista un riesgo aumentado de que las bacterias pasen al torrente sanguíneo.
En resumen, en la actualidad se usan una gran variedad de tratamientos farmacológicos en la Miocardiopatía Hipertrófica y por supuesto, se descubrirán nuevos medicamentos en el futuro. La necesidad de cualquier tratamiento y la elección del tratamiento deben realizarse de forma individualizada y puede cambiar en un mismo individuo durante los años.
En una minoría de casos es necesario realizar un trasplante cardiaco. Se valora la necesidad de trasplante en los casos de insuficiencia cardiaca avanzada donde la actividad contráctil del corazón está severamente deteriorada.
Existen otras formas de tratamiento las cuales pueden, en ocasiones, ser recomendadas en la Miocardiopatía Hipertrófica. Estos tratamientos se describen brevemente a continuación:
La fibrilación auricular puede ser eliminada tras la aplicación en el pecho de una pequeña descarga eléctrica controlada (choque eléctrico). Este procedimiento se realiza bajo anestesia general. Esta cardioversión es frecuentemente útil y ventajosa ya que alivia los síntomas y puede evitar la necesidad de anticoagulantes.
Como se ha descrito con anterioridad la señal eléctrica normal que viaja descendentemente hacia los ventrículos puede fallar y en esta situación se precisa de la implantación de un marcapasos. Esto implica la colocación de una pequeña caja metálica que contiene una batería bajo la piel del pecho (bajo la clavícula) conectada a un cable fino que a través de las venas llega al corazón. Por medio del cable aplica pequeños impulsos eléctricos en el momento necesario.
Los marcapasos también pueden ser empleados para invertir la activación eléctrica normal y activar primero la punta del corazón. Esto permite a la punta contraerse antes que el tabique y de esta forma disminuir la obstrucción en la salida del corazón con lo que se aumentaría la cantidad de sangre expulsada en cada latido. Este mecanismo puede beneficiar a un grupo de pacientes con obstrucción. Esta forma de tratamiento sólo es útil en los casos de Miocardiopatía Hipertrófica Obstructiva.
Un pequeño número de pacientes con Miocardiopatía Hipertrófica tienen un riesgo aumentado de muerte súbita. La muerte puede ocurrir con mínimos síntomas previos o sin ningún síntoma de aviso. La muerte súbita suele ser resultado de una arritmia (cuando el corazón late demasiado rápido y de forma caótica) la cual puede llevar al corazón a dejar de latir (parada cardiaca). Es importante diferenciarlo del ataque cardiaco o infarto cardiaco en el que el flujo en las arterias que aportan sangre al corazón se bloquea y el músculo cardiaco queda sin oxígeno.
A pesar de que la muerte súbita es la complicación
más temida de la Miocardiopatía Hipertrófica,
es un fenómeno relativamente infrecuente y puede ser
prevenida en la mayoría de los pacientes. En estudios
recientes se ha sugerido que la mayoría de los pacientes que
están en riesgo pueden ser identificados por medio de
pruebas sencillas y no agresivas. Sería suficiente con la
realización de un Holter, una prueba de esfuerzo y un
ecocardiograma. Los factores de riesgo de muerte súbita
identificados son: hipertrofia ventricular izquierda severa,
episodios de pérdida de conciencia inexplicados, taquicardia
ventricular no sostenida (estos son latidos anormales originados en
el ventrículo que pueden ser identificados con un Holter),
respuesta anormal de la tensión arterial durante la prueba
de esfuerzo (cuando la presión arterial no se eleva de forma
normal o incluso cae durante el ejercicio) y la historia familiar
de muerte súbita.
En los pacientes que tienen un riesgo elevado de muerte
súbita se recomienda habitualmente tratamiento
farmacológico (amiodarona como se ha descrito previamente) o
en los de mayor riesgo Desfibrilador Automático Implantable
(DAI). La elección del tratamiento más oportuno
requiere de una valoración cautelosa y debe ser
individualizada.
El DAI consiste en una caja metálica de tamaño algo mayor a un marcapasos que se coloca bajo la piel del pecho (bajo la clavícula). Esta caja que contiene la batería y los circuitos de funcionamiento se conecta a unos cables finos que a través de las venas llegan al lado derecho del corazón. Estos cables quedan en contacto con el músculo cardiaco en un extremo y conectados a la caja por el otro extremo. El DAI es capaz de registrar y descargar impulsos eléctricos en el momento en el que se pierda la actividad eléctrica normal. El procedimiento de implantación se realiza bajo anestesia general.
En la mayoría de los pacientes la enfermedad no interfiere con el tipo y la calidad de vida en ningún aspecto. Algunas personas pueden presentar síntomas relacionados con el ejercicio y encontrar que no pueden realizar el mismo esfuerzo físico que otras personas normales de su edad. Se recomienda consejo médico antes de iniciar actividades físicas que requieran un esfuerzo importante. En algunos casos se recomendará evitar esfuerzos físicos competitivos o esfuerzos extenuantes.
Como en otras enfermedades cardiacas, los afectados puede encontrar dificultades para obtener un seguro de vida y/o sufrir cargas (primas) por parte de la compañía aseguradora. La postura de las compañías de seguros en este tema es la de continuar recabando información referente a la familia y otra información médica del asegurado.
Respecto a las pruebas genéticas, no se recomienda ni son necesarios test genéticos cuando se solicita un seguro de vida, pero sí se pedirán los resultados de cualquier test realizado con anterioridad. La compañía aseguradora no debe solicitar la realización de pruebas genéticas.
La mayoría de los pacientes con Miocardiopatía Hipertrófica tienen al menos un familiar de primer grado afectado, es decir, padre o madre, hermano o hermana o hijos. Cuando una persona es diagnosticada de Miocardiopatía Hipertrófica es recomendable realizar una valoración a todos los familiares de primer grado para descartar la enfermedad. Es importante recordar que la Miocardiopatía Hipertrófica puede estar presente a pesar de no tener síntomas. La evaluación incluye la realización de una exploración física, un ECG y una ECO.
En la mayoría de los adultos en los que los resultados de las pruebas anteriores sean negativos el diagnóstico de Miocardiopatía Hipertrófica puede ser excluido. En un pequeño número de pacientes en los que no hay evidencia física de la enfermedad el gen alterado puede estar presente. En esta situación, el portador del gen alterado será normal pero podría pasarlo a la próxima generación.
En los niños, no obstante, son necesarias revisiones periódicas hasta que se finaliza completamente la época de crecimiento corporal, habitualmente hasta los 20 años de edad, ya que los síntomas pueden no aparecer hasta la edad adulta. Se recomienda revisiones anuales durante la pubertad hasta que cumplan los 20 años en los hijos de padres afectados. Se aconseja realizar ECG y ECO en cada visita.
Claramente, la mayor preocupación de un padre afectado es el riesgo de pasar la enfermedad a sus hijos. No es posible generalizar el consejo sobre el riesgo y cada caso precisa una consideración individualizada. Por ejemplo, en una familia en la cual se haya observado una patrón de transmisión dominante de una generación a la siguiente, (ver figura 2) la probabilidad de un padre de pasar el gen alterado a su hijo es del 50%. En otros casos, donde no se ha observado ningún patrón de herencia en la familia la probabilidad de transmitir la enfermedad a la descendencia posiblemente sea también del 50%.
Incluso si un niño hereda el gen anómalo, el grado de afectación puede ser muy variable. No existe un método eficaz para predecir cual va a ser la severidad de la enfermedad en los individuos que la hereden. En general se recomienda revisar a los hijos de los afectados periódicamente hasta la edad adulta. En caso de que no presenten la enfermedad en la edad adulta joven (20-30 años) es extremadamente infrecuente que la desarrollen a una edad más avanzada.
El embarazo en la Miorcardiopatía Hipertrófica es bien tolerado y seguro para la mayoría de las mujeres con Miocardiopatía Hipertrófica. El embarazo y el parto suelen ser completamente normales.
No obstante, como ocurre con mujeres con cualquier enfermedad del corazón, el embarazo conlleva un riesgo ligeramente mayor para las mujeres con Miocardiopatía Hipertrófica. Esto se debe a que el embarazo supone un aumento del trabajo del corazón.
Las mujeres pueden sentir que aparecen síntomas por primera vez durante el embarazo o sus síntomas habituales aumentan en intensidad. Además, la pregunta de la medicación durante el embarazo o la concepción surge como preocupación en muchos casos. Por todas estas razones es mejor planear el embarazo con antelación y discutir todos estos aspectos con su médico o cardiólogo.
En el caso de que desee recibir la anestesia epidural durante el parto es importante discutir este aspecto con su medico previamente. En algunas pacientes con Miocardiopatía Hipertrófica la anestesia epidural puede causar una caída excesiva en la tensión arterial por lo que su obstetra debería ser informado de su enfermedad.
Su médico de familia o médico de cabecera debería estar involucrado en todas las decisiones. El diagnóstico de Miocardiopatía Hipertrófica es habitualmente realizado por un cardiólogo quien debería implicarse en el seguimiento. Los detalles y frecuencia de las visitas varía de unos centros a otros y dependen de cada paciente concreto. En general, se aconseja a todas las personas con la enfermedad realizarse una evaluación médica anual.
Para aquellos que son más sintomáticos y necesitan medicación puede ser necesario un seguimiento más frecuente. Después de las pruebas diagnósticas iniciales la necesidad de nuevas pruebas dependerá de cada caso y las circunstancias locales así como de los avances en el conocimiento de la enfermedad.
El sobrepeso supone una sobrecarga para el corazón. Se recomiendan hábitos saludables y sensatos para mantener el peso en el rango normal según la estatura y edad. Cualquier incremento rápido en el peso es probable que se deba a una retención de líquido y se recomienda consultar este hecho con su médico.
No existe suficiente evidencia de los perjuicios del alcohol en la Miocardiopatía Hipertrófica, aunque se recomienda moderar su consumo, ya que el alcohol tiene un efecto depresor del músculo cardiaco.
En general los pacientes con miocardiopatía hipertrófica no tienen limitaciones respecto a la conducción de vehículos a menos que existan síntomas que produzcan distracción o síntomas debilitantes (por ejemplo, pérdida de conciencia o arritmias malignas), en cuyo caso debe notificarse a la Dirección General de Tráfico. Es posible que los afectados encuentren problemas para la obtener licencias de vehículos de transporte de sustancias peligrosas o pilotos de aviación. En esos casos el riesgo debe evaluarse de forma individualizada.
Su médico puede recomendarle la vacunación para evitar un brote severo de gripe. Desafortunadamente la vacunación no siempre es eficaz.
Es deseable visitar a su médico general o de familia para valoración antes de viajar. Si viaja al extranjero, debería recabar información de su agencia de viajes relativa al seguro sanitario del país al que se dirige. Puede conseguir un formulario E111 el cual ofrece información acerca de la asistencia sanitaria en los países de la Comunidad Europea en la mayoría de oficinas de correos o centros sanitarios.
Las personas con síntomas severos y limitantes pueden solicitar concesiones o subsidios. No es posible establecer normativas que sirvan para todos los casos y la valoración debe ser individualizada.
Se está investigando acerca de la Miorcardiopatía Hipertrófica a diferentes niveles en muchos países del mundo. Como se ha comentado con anterioridad, la investigación genética tiene como objetivo identificar los genes reponsables que pueden causar la Miocardiopatía Hipertrófica y examinar el mecanismo de producción de la enfermedad. En particular, ¿por qué estas anomalías en estos genes causan desorganización de las células musculares cardiacas y engrosamiento del miocardio? ¿Qué efecto tienen estas alteraciones genéticas en la forma como se contrae cada célula muscular?. La investigación clínica pretende determinar las razones por las que se producen los síntomas y la muerte súbita y encontrar nuevas formas de tratamiento.
En la mayoría de los pacientes con Miocardiopatía Hipertrófica la anestesia general o local no se asocia a un riesgo aumentado. Su anestesista debe ser informado de su enfermedad y le controlará de forma cautelosa. En ocasiones la anestesia regional (por ejemplo, bloqueo espinal) usada en ciertas operaciones, puede ser más problemática y debe ser considerada y discutida con su anestesista y cardiólogo.
Si los síntomas empeoran debería consultar con su médico, quien contactará con su cardiólogo en caso necesario. Si no es posible contactar con su médico de familia o se trata de una emergencia debería acudir al servicio de emergencias más cercano donde puede ser atendido por médicos de forma urgente.
Si usted, tiene pérdida de conciencia o sensación de mareo debe informar a su médico inmediatamente. De igual modo, si tiene fatiga o su sensación de falta de aire empeora debería consultar con su médico.
Esta es una decisión personal y puede discutirla con su médico si lo desea. Generalmente sus hijos tendrán una probabilidad del 50% de heredar la enfermedad y nosotros no somos capaces de predecir con antelación la severidad con la que se presentará en caso de padecerla. Sí decidiera tener hijos o ya los tiene es importante que ellos sean valorados por sus médicos desde pequeños.
Su médico de familia tendrá conocimiento de su enfermedad. En cualquier caso existe información on-line acerca de esta enfermedad fácilmente disponible para los médicos, o bien puede encontrarla en la mayoría de los libros de cardiología. Si, no obstante, su médico precisara de información específica podría contactar en nuestro país con la Sociedad Española de Cardiología (http://www.secardiologia.es) o la Fundación Española del Corazón (http://www.fundaciondelcorazon.com), o a través de la página web (www.murciasalud.es/miocardiopatias) con cardiólogos especialistas. También puede obtener información a través de la Sociedad de Miocardiopatías Inglesa (Cardiomyopahty Association http://www.cardiomyopathy.org)
A la mayoría de las personas no les afecta en su vida sexual. No obstante, en ocasiones, puede sufrir dolor torácico o sensación de falta de aire. La medicación, en ocasiones, también puede afectar a la erección o la potencia sexual. Si este es el caso debería consultar con su médico.
A pesar de que existe una operación para reducir el engrosamiento del músculo, está intervención se reserva a los casos con síntomas importantes y debilitantes que no responden a la medicación. Esto se debe a que a pesar de su efectividad se pueden producir complicaciones importantes durante la cirugía.
La mayoría de los trabajos no deben verse afectados por esta enfermedad. Algunas profesiones como, por ejemplo, pilotos de aviación están sujetas a normas estrictas. En el caso de que precise rellenar una encuesta sobre su situación de salud debería informar a su empresa de su enfermedad. Su médico podría facilitarle más información al respecto en caso necesario.
La mayoría de los pacientes en riesgo elevado pueden ser
identificados por medio de pruebas no agresivas, como son: la
historia clínica, la ecocardiografía, la prueba de
esfuerzo y el Holter. Si usted tiene un riesgo alto su
cardiólogo le comentará los posibles tratamientos
disponibles.
El músculo de su corazón no crecerá más después de la época de crecimiento corporal (aproximadamente 20 años de edad) a menos que padezca la forma de desarrollo tardío. En un pequeño porcentaje de pacientes el músculo se adelgaza y la cavidad del ventrículo aumenta de tamaño con la edad. En algunos casos esto puede asociarse a un aumento de la fatiga y las palpitaciones.
Esta es una pregunta difícil de responder. Lo que podemos decir es que los investigadores de todo el mundo están trabajando para conseguir un mejor diagnóstico y tratamiento de esta enfermedad y también para reducir el riesgo de muerte súbita. En cuanto estén disponibles los nuevos tratamientos podrá comentarlos con su cardiólogo.